蛋白免疫印迹
(Western Blot, WB)
一、实验原理
蛋白免疫印迹(Western Blot, WB)采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
WB 是进行蛋白质分析最流行和成熟的技术之一。
二、操作步骤
1. 蛋白样本提取制备
1.1 细胞或组织裂解
1.2蛋白定量
1.3电泳上样样品的准备
2、电泳
2.1 SDS-PAGE凝胶的制备
2.2蛋白分子量Marker
2.3阳性对照
2.4内参对照
2.5上样与电泳
3、转膜与显色(Western Blot)
3.1 胶中蛋白的检测
3.2蛋白转膜
3.3膜上蛋白的检测:丽春红
3.4膜的封闭
3.5一抗的孵育
3.6 二抗的孵育
3.7 显色
实时荧光定量PCR
(Realtime fluorescence quantitative PCR, qPCR)
一、概念
荧光定量PCR(Realtime fluorescence quantitative PCR, qPCR)也称作实时荧光定量PCR。即在PCR的扩增过程中,通过荧光的信号,对PCR的进程进行实时的定性、定量检测,最后通过标准曲线对初始模板进行定量分析的方法。
二、分类
根据化学发光原理分为:SYBR染料法和TaqMan探针法。
SYBR染料法:
SYBR染料法利用SYBR Green I分子的特点,SYBR Green I是一种结合于所有双链DNA(dsDNA)双螺旋小沟区域的具有绿色激发波长的染料。SYBR Green I只有和双链DNA结合后才发荧光,游离的染料分子不发光,在新合成链延伸过程中SYBR Green I掺入双链中,变性时DNA双链解开,SYBR Green I 游离出来,无荧光。
在PCR反应体系中,加入过量SYBR Green I荧光染料, SYBR Green I荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR Green I染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。
SYBR染料法需要注意引物的特异性,因为非特异扩增产物和引物二具体均为dsDNA,所以SYBR染料法只能通过引物来保证特异性,SYBR染料法的优点在于简单且成本较低。
TaqMan探针法:
TaqMan探针法核心是探针分子,TaqMan探针是单链DNA,5'端偶联发光基团,3'端偶联淬灭基团,游离的完整探针是检测不到荧光信号的,发光基团发出的荧光会被淬灭基团吸收淬灭,探针被水解,发光基团和淬灭基团远离就可以检测到荧光信号。
反应开始时,模板链经热变性解链形成单链,TaqMan探针优先跟模板链退火,引物随后退火到模板上,之后进行链的延伸,延伸过程中Taq酶发挥5'-3'外切酶活性,遇到探针会从5'端逐个碱基切除探针,发光基团会跟淬灭基团分开,因此荧光检测系统可以接收到荧光信号,每扩增一条DNA链,就有一个荧光分子形成,荧光信号的累积和PCR产物形成是同步的。
TaqMan探针法的特异性除了由引物提供,更由探针分子保证,因其退火温度更高,所以TaqMan探针法特异性更好,在一个反应体系中加入多条探针,可以做多个基因同时检测。
三、实时荧光定量PCR步骤:
样本制备
RNA提取
反转录
PCR扩增
数据处理
四、扩增曲线和熔解曲线:
扩增曲线是PCR过程中,以循环数为横坐标,以荧光强度为纵坐标所绘制的曲线,随着PCR反应的进行,扩增产物不断积累,荧光信号强度不断增加,仪器每经过一次循环,收集一次荧光信号,通过荧光强度的变化监测扩增产物量的变化,扩增曲线应平滑完整。熔解曲线是用来验证扩增产物特异性的,如果产物是单一条带,熔解曲线就会出现单峰;如果有引物二聚体或其它非特异性扩增,就会出现至少两个峰。
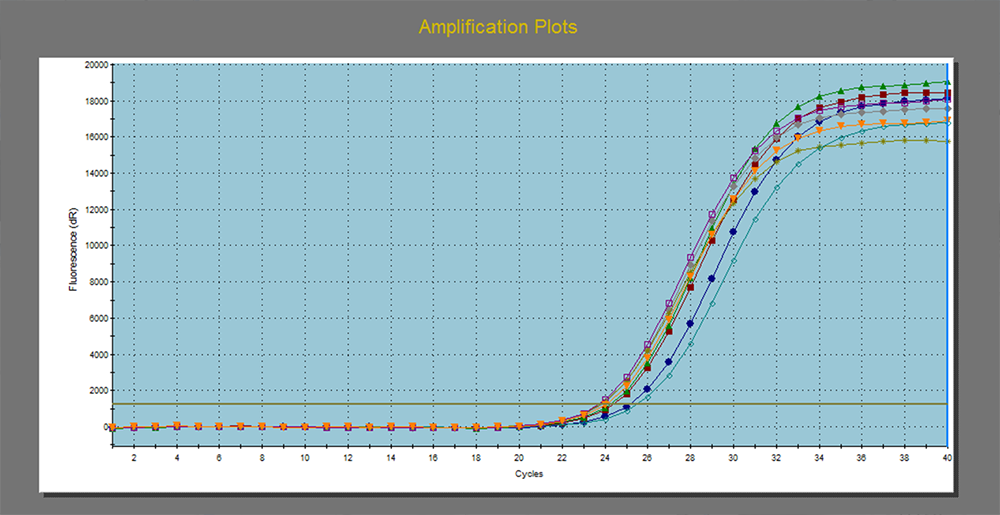
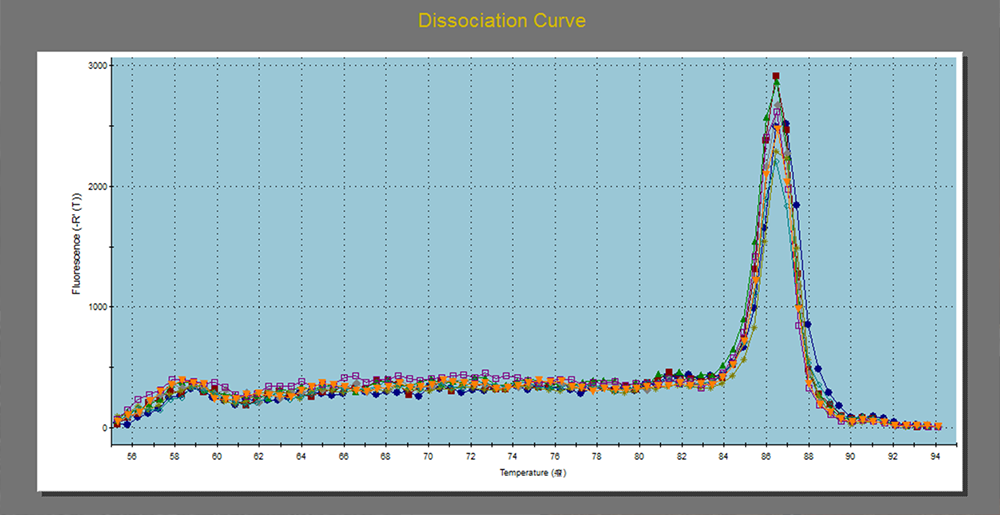
五、Ct值
PCR扩增过程中,扩增产物的荧光信号达到设定的阈值时所经过的扩增循环次数。
酶联免疫吸附实验
(enzyme linked immunosorbent assay,ELISA)
一、实验原理
酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)是免疫学和分子生物学中广泛使用的实验技术。该技术的原理是抗原-抗体结合,并利用酶标记和比色检测来测定目标分子。
二、检测方法
ELISA根据不同实验设计可分为以下几种类型:
1. 直接ELISA法:通过一段时间的孵育使抗原附着在微孔板上,经过简单的洗涤后,添加与酶偶联的抗体使其与抗原结合。使用洗涤液将未结合的抗体洗掉,添加酶的底物使酶活性产生颜色变化来显色,在规定时间后通过化学手段终止酶活性,使用酶标仪在指定波长处读取显色情况。
2. 间接ELISA法:该方法在直接法的基础上添加了酶标二抗进行检测。抗原与一抗结合后,洗涤并通过添加与酶偶联的抗物种抗体(二抗)来检测结合的抗体。二抗对于一抗的物种具有特异性。
3. 夹心ELISA法:通过将捕获抗原的抗体(一抗)附着在微孔板上,使用洗涤液将未结合的抗体洗掉,添加抗原并被一抗捕获。再添加能结合样品分子另一位点的二抗,二抗会偶联某种酶,添加酶的底物使酶活性产生颜色变化来显色。该方法提高了检测的灵敏度和特异性,是最常见的ELISA实验形式。
4. 竞争ELISA法:通过对干扰预计信号的程度进行定量,以测定分析物的数量。将特异性抗体吸附在微孔板上,加入待测样本,和生物素标记的检测抗原,二者竞争与固相抗体结合,然后加入辣根过氧化物酶标记的亲和素,经过温育和彻底洗涤后加入显色底物。显色的深浅与样品中待测物质含量呈负相关。


